Octet과 Duplet의 차이점 | Octet 대 Duplet
주요 차이점 - 옥텟 대 듀플렛
자연에서 화학적으로 활성 및 비활성 인 원자 또는 화합물이 존재합니다. 이 특성은 주로 원자의 가장 바깥 쪽 껍질에 존재하는 전자의 수에 따라 달라집니다. 불완전한 껍질을 가진 원자는 안정화되기 위해 전자 구성을 완성하기 위해 활성화 될 수 있습니다. 비활성 상태의 원자는 완전한 전자 구성을 갖습니다. 따라서, 특별한 조건이 아니면 이러한 원자는 다른 원자와 반응하지 않습니다. 고귀한 가스는 자연에서 항상 비활성입니다. 따라서 불활성 가스로 알려져 있습니다. 불활성 가스는 주기율표의 8 번째 칸에있다. 같은 기간 (행)에있는 다른 원소들은 그 기간이 끝날 무렵에 불활성 가스의 전자 배열을 얻는 경향이 있으며, 이는 본질적으로 가장 안정한 형태이다. 활성 원자는 옥텟 규칙 또는 듀플 렛 규칙 에 따라 전자 수를 완료하는 경향이 있습니다. octet과 duplet의 주된 차이점은 옥텟이 가장 바깥 쪽 껍질에 최대 8 개의 전자를 갖는 원자 또는 이온 인 반면에 914> 윗부분은 가장 바깥 쪽 껍질에 최대 2 개의 전자를 갖는 원자. 목차
1. 개요 및 주요 차이점2. 옥텟이란 무엇입니까?
3. Duplet은 무엇입니까?
4. 나란히 비교 - Octet 대 Duplet
5. Summary
옥텟이란 무엇입니까? 옥텟은 원자 또는 그 원자의 가장 바깥 쪽 껍질에 8 개의 전자를 갖는 이온이다. 헬륨을 제외한 모든 희귀 가스는 8 개의 전자를 가지고 있으며 자연 상태에서는 불활성입니다. 희가스의 전자 배열은 항상 다음과 같이 끝납니다.
예를 들어, 네온의 전자 배열은 1s-9992s-9999이다. 2p
6999. 네온은 불활성 가스입니다. 가장 바깥 쪽 궤도에 7, 6 등의 전자를 갖는 다른 원소들은 외부로부터 전자를 얻어 옥텟 규칙에 따르는 경향이있다. 1 개, 2 개 등의 전자를 갖는 몇몇 다른 원소는 전자를 잃어 버려 가장 가까운 불활성 가스의 전자 배치를 얻는 경향이있다. 그러나 주기율표의 중간에있는 다른 원소들은 초과 전자를 가진 원소와 새로운 결합을 형성하여 전자를 공유하고 옥텟이된다.
- 03 ->
그림 01: 네온, 옥텟듀플 릿이란? 수소 원자와 헬륨 원자는 본질적으로 가장 작은 원소이며 핵 주위에 단 하나의 궤도를 가지고있다. 이 궤도는 1s 궤도라고 부릅니다. 이 궤도는 최대 두 개의 전자를 포함 할 수 있습니다. 수소 원자는 하나의 전자를 가지고 헬륨은 두 개의 전자를 가지고있다. 따라서 헬륨은 듀플렛 (duplet)이라고합니다.헬륨은 가질 수있는 최대 전자 수를 가지고 있습니다. 따라서 그것은 본질적으로 안정된 요소입니다. 따라서 헬륨은 불활성 가스이기도합니다. 그러나 수소는 단 하나의 전자를 가지고 있으며 그것의 유일한 궤도는 불완전합니다. 따라서, 수소 원자는 단독으로 매우 반응성이 있으며, 전자를 공유함으로써 다른 수소 원자와 공유 결합을 형성하는 경향이있다. 그리고 나서 이들 수소 원자는 이제 그들의 가장 바깥 쪽 궤도에 2 개의 전자를 가지기 때문에 듀플렛이됩니다. 그러나 리튬은 전자의 가장 바깥 쪽 궤도에서 전자를 제거함으로써 듀플렛 (duplet)처럼 행동 할 수도 있습니다. 리튬의 전자 배열은 1s-999s-9999-999이다. 2s 9 9 9 9 전자를 제거함으로써, 그것은 듀플렛이 될 수있다. 이 경우, He, H999 및 Li999 + 999는 안정한 듀플렛으로 존재할 수있는 듀플렛이다. 모든 듀플렛은 전자 구성이 다음과 같이 끝난다. ns 2
그림 02: 헬륨, 듀플렛 옥텟과 듀플렉스의 차이점은 무엇입니까? - diff 기사 테이블 중간 -> 옥텟 대 듀플렛 옥텟은 바깥 쪽 껍질에 8 개의 전자가 있습니다. 듀플렛은 가장 바깥쪽에 2 개의 전자를 가지고있다. 일반적인 전자 구성
옥텟은 끝 부분에 2 999 9 9 9 9 9 전자 구성을 가지고있다. Duplet은 마지막에 ns
2
유형 구성을가집니다.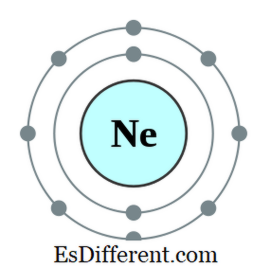
궤도 수
궤도는 최소 두 개의 궤도를 가질 수 있습니다.
듀플렛에는 궤도가 하나뿐입니다. 오비탈 유형 옥텟에는 s, p, d, f 등과 같은 모든 유형의 궤도가있을 수 있습니다. 듀 플릿에는 궤도 만 있습니다. Summary - Octet 대 Duplet 모든 요소는 안정화되는 경향이 있습니다. 그러나 불완전한 전자 배열의 경우, 원자는 안정 할 수 없다. 따라서 그들은 전자를 얻거나, 잃거나 공유함으로써 전자로 껍질을 채우기 위해 매우 반응성이있다. 옥 테트 또는 듀플 렛 규칙에 순응하는 원자 또는 분자는 안정적이다. octet과 duplet의 주요 차이점은 octet은 가장 바깥쪽에있는 궤도에 8 개의 전자를 가지고있는 반면, duplet은 궤도에 2 개의 전자를 가지고 있다는 것입니다. 참고 문헌: 1. Nema, P., 2011. Topperlearning. [온라인] http: // www. topperlearning. 원자력의 구조 - 46317 / 대답 [Accessed 29 05 2017]. 2. Chang, R., 2010. 화학. 10th ed. 뉴욕: 맥그로 힐. 3. 곧., 2015. 스태커를 그레이드. [온라인] http: // gradestack에서 이용 가능합니다. co.kr / NTSE-Complete-Course / Chemical-Bonding / Chemical-Activity-of-An / 19176-3853-37737-studyw [Accessed 29 05 2017]를 참조하십시오. 이미지 예식: 1. "전자 셸 002 헬륨 - 레이블 없음"Pumbaa (Greg Robson의 원작) - Commons Wikimedia 를 통한 전자 셸 다이어그램 (해당 레이블 버전) (CC BY-SA 2.0 영국) 2. "Electron shell 010 Neon"Commons Wikimedia를 통해 Pumbaa (Greg Robson의 원작) (CC BY-SA 2. 0 영국)


