시차 및 시린스 형태의 차이점 | 지그재그 형과 Eclipsed Conformation
분자. 안정성 측면에서, 엇갈린 형태는 변형 된 형태보다 안정적이다. 엇갈린 확인의 형성은 그것의 구조 에너지가 최소이기 때문에 더 유리하다.
이것은 엇갈린 모양과 단조 된 모양 사이의 주요 차이
입니다. 지그재그 모양이란 무엇입니까? 엇갈림 형태는 치환기 a, b 및 c가 부착 된 에탄 유사 분자 (CH3-CH3-C9-C9-C9-Y9)의 화학적 형태이다 d, e 및 f로부터 최대 거리에서. 이 경우 비틀림 각도는 60 °이고 구조 에너지는 최소입니다. 이 확인을위한 주요 요구 사항은 2 개의 sp 9999,999 하이브리드에 연결된 개방형 단일 화학 결합이다. n -butane과 같은 일부 분자는 스 태거 드 확인의 특별한 버전을 가질 수 있습니다: gauche 및 anti.
식 물성표 란 무엇입니까? 단일 본드가 두 개의 sp
3 하이브리드 화 된 원자를 연결하는 경우 개방형 (open-chain) 형태의 가려진 형태가 존재할 수있다. 이 경우 인접 원자 (예: A와 B)에있는 두 개의 치환기 (즉, -X와 -Y)가 가장 근접합니다. 즉, 토션 각 X-A-B-Y는 분자 내에서 0 °이다. 이 확인은 입체 장애 때문에 최대 구조 에너지를 가지고있다.
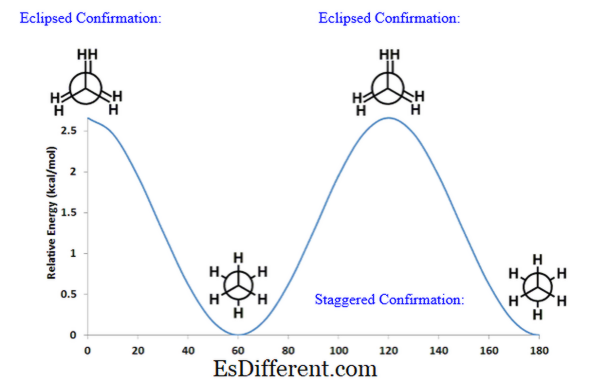
위의 그림은 지그재그 형태의 포텐셜이 최소 포텐셜 에너지를 가지고 있음을 보여줍니다. 이것은 이것이 가장 안정적인 형태이며 다른 확인보다 가장 유리한 형태 일 수 있음을 의미합니다.
Eclipsed Conformation: 위의 그래프에 따르면, 가려진 확인은 최대 잠재 에너지를가집니다. 이것은 가려진 형태가 전이 상태이며 결코이 형태로 존재할 수 없다는 것을 의미합니다. 정의: 구조:
구조는 분자가 원자와 결합을 유지하면서 분자가 취할 수있는 다른 위치이다. 이 경우 유일한 변형은 분자의 특정 부분이 구부러 지거나 꼬여지는 각도입니다. 비틀림 각 (2 면체 각도):두 개의 원자를 공유하는 두 세트의 세 개의 원자를 통해 평면 사이의 각도를 나타냅니다. 즉, 두 교차 평면 사이의 각도입니다.
참고 문헌:
"Eclipsed conformation"(Wikipedia) 여기에서 "Staggered conformation"(Wikipedia)

"알칸의 구조: 탄소 - 탄소 결합에 관한 연구"(Kshitij Education India) 여기에서 "높은 알칸의 입체 구조"(SparkNotes) 여기에서

"알칸의 입체 분석"(유기 화학 입문)
Image Courtesy: "Newman projection ethane"
Aglarech at de. 위키 백과;
Leyo
- Commons Wikimedia를 통해 자신의 저작물 (공개 도메인)